Lehren aus meinen Einsätzen
„JEDER Einsatz macht mich besser!“ Mit diesem Satz motiviere ich u.a. nachts um 3 Uhr durch strömenden Regen zu einem Einsatz mit nicht gerade begehrten Einsatzbild im freien Feld zu fahren/fliegen. Aber ich stehe dahinter: JEDER Einsatz macht mich besser und ich kann immer etwas lernen. Kein Einsatz ist wie der Andere und daher gibt es immer neue Erkenntnisse und Erfahrungen. Wichtig ist nur, diese Eindrücke im Nachhinein nochmal zu reflektieren und die entsprechenden Schlüsse draus zu ziehen. Was für Besonderheiten bot dieser Einsatz? Wo waren unsere Stärken, wo die Schwächen? Was will ich weiter entwickeln bzw. das nächste mal besser machen?
Ein paar dieser Eindrücke will ich hier exemplarisch gerne weiter geben und dadurch ermutigen sich selbst die Mühe zu machen die eigenen Erlebnisse standardisiert und selbstkritisch zu analysieren.
Fallbericht Atropin bei der Reanimation

Heute möchte ich kurz von einer prolongierten Reanimation berichten:
Eine 54jährige Patientin ruft wegen "Kreislaufbeschwerden" den Rettungsdienst. Dem RTW-Team berichtet die Patientin, dass sie gestern erstmalig bei einer Kardiologin gewesen sei, die eine "Herzrhythmusstörung" (?) festgestellt habe und sie zu einer Koronarangiographie (?) eingewiesen habe - nun habe sie Brustschmerzen und Schwindel. Noch während die RTW-Besatzung das EKG anlegt und parallel einen Venenzugang legt kollabiert die Patientin und es sieht zunächst wie ein tonisch-klonischer Krampfanfall aus. Schnell wird aber klar, dass der scheinbare Krampfanfall Ausdruck der cerebralen Minderperfusion bei Kreislaufstillstand ist. Es wird die Reanimation begonnen, das EKG zeigt ein Kammerflimmern und es erfolgt eine prompte Defibrillation. Der Hubschrauber-Notarzt erreicht die Einsatzstelle leider erst ca eine halbe Stunde später aufgrund eines längeren Anflugs und Nebel an der Einsatzstelle, so dass er nochmal über eine weitere Distanz zugebracht werden muss.
Die Patientin befindet sich trotz qualitativ hochwertiger Reanimationsmassnahmen mit regelmäßigen Defibrillationen und Gaben von Adrenalin und Amiodaron im persistierenden Kammerflimmern. Der Atemweg ist mit einer supraglottischen Atemwegshilfe gesichert, das RTW-Team ist jedoch nicht glücklich mit der Dichtigkeit.
Es besteht also eine grundsätzlich schlechte Situation: Es war zwar ein beobachteter Kreislaufstillstand einer relativ jungen Patientin mit unmittelbarem ALS-Beginn, aber selbst nach 7mg Adrenalin, 450mg Amiodaron und 5 Defibrillationen befindet sich die Patientin immer noch im persistierenden Kammerflimmern. Wenn man sich das initiale EKG vor dem Kollaps genau anschaut, sieht man ST-Hebungen, so dass man in Zusammenschau von einer prolongierten Reanimation bei Myokardischämie ausgehen muss.
Im Team wird besprochen, dass parallel zur Reanimation die Patientin vom Notarzt endotracheal intubiert und parallel der Transport vorbereitet wird, dann will man gemeinsam entscheiden, ob es noch zum Transport in das ca 25km entfernte Zentrumsspital kommt. Bei der letzten Rhythmuskontrolle vor der Intubation wird erfreulicherweise festgestellt, dass sich nun doch ein ROSC eingestellt hat. Wenig später beginnt die Patientin auch mit einer Spontanatmung. Da sie aber anhaltend tief bewußtlos ist, wird eine Narkose eingeleitet und die Patientin intubiert.
Kurz darauf kommt es zu einem erneuten Kammerflimmern und es wird die Reanimation erneut begonnen. Das Team beschließt die Patientin ggf. unter Reanimation durch ein mechanisches Reanimationsgerät in die Klinik zu transportieren. In der Folge ist beinahe jede Defibrillation erfolgreich und es stellt sich ein zunächst normofrequenter Rhythmus ein. Innerhalb der nächsten Minuten kommt es dann aber jeweils zu einer Bradykardie mit Blutdruckabfall und schließlich wieder Kammerflimmern. Ein externer Schrittmacherversuch bleibt frustran, auch bei maximaler Energie kommt es zu keine elektromechanischen Kopplung. Das RTW-Team bietet dem Notarzt Atropin an, dieser lehnt aber zunächst dankend ab, da die Patientin mittlerweile über 10mg Adrenalin erhalten hat und er sich keinen weiteren Benefit durch Atropin erhofft.
Während des bodengebundenen Transports fällt in den Unterlagen der Patientin auf, dass diese neuerdings eine recht hohe Dosis Betablocker einnimmt. Dadurch könnte man sich erklären, dass die Patientin trotz der hohen Adrenalin-Gesamtdosis im ROSC nie wirklich tachykard wurde. Nun wurde in der weiterhin instabilen und auch verzweifelten Situation ein Versuch mit Atropin unternommen. Es mussten zwar 2x1mg Atropin verabreicht werden, dadurch konnte aber die Grundfrequenz deutlich angehoben werden. Darunter stabilisierte sich durch den verbesserten Auswurf auch etwas der Blutdruck. Schlußendlich konnte die Patientin über den Schockraum direkt in das Herzkatheterlabor verbracht werden, wo die verschlossene LAD wiedereröffnet wurde und sich der Zustand deutlich stabilisierte. Über den weiteren Verlauf ist nichts bekannt.
Warum stelle ich den Fall hier vor?
In den aktuellen ERC-Leitlinien wird Atropin bei der Reanimation der nicht defibrillationswürdigen Rhythmen nicht empfohlen. Es gibt nur Fallberichte und keine kontrollierten Studien, die einen Benefit ergaben. Lediglich bei den bradykarden Rhythmusstörungen wird Atropin weiterhin empfohlen mit einer Einzeldosis von 0,5mg bis zu einer Gedsamtdosis von 3mg, dem sagenumwobenen "kompletten Vagusblock". Ansonsten wird bei der Bradykardie niedrigdosiertes Adrenalin oder ein transkutaner Schrittmacher in der Präklinik empfohlen. Zudem gibt es noch weitere pharmakologische Taschenspielertricks, die ich aber hier mal nicht berücksichtigen möchte.
Schlußendlich handelt es sich ja hier auch nur um einen Einzelfall, in dem Atropin hilfreich war und man sollte dies auch nicht überbewerten. Vermutlich hatte durch die Betablockade das Adrenalin nicht den gewohnten Effekt und durch die Parasympathikolyse des Atropins bediente man sich eines anderen biochemischen/pharmakologischen Wegs.
Wie allgemein bekannt ist stehe ich auch zu 100% hinter den ERC-Leitlinien und unterrichte sie mit Leidenschaft. Dennoch muss man eben immer mal wieder sagen, dass es sich bei Leitlinien egal welcher Art immer um einen Konsens handelt, der für die Mehrheit der betroffenen Patienten richtig ist. Gerade der erfahrene Anwender muss aber auch die Grenzen von Leitlinien erkennen und dann manchmal die Empfehlungsgrenzen verantwortungsvoll überschreiten.
Oder wie es schon mir eindrücklich erklärt wurde:
"Leitlinien sind wie Straßenlaternen, sie weisen einem den Weg, aber nur der Betrunkene hält sich daran fest."
Pingelig betrachtet war Atropin ja auch in den Phasen des ROSC als Periarrestrhythmus indiziert und nur während der Reanimation nicht, aber in diesen Fällen mit wiederholten Reanimationsphasen und dann wieder ROSC tun sich die Leitlinien eh schwer, was auch absolut verständlich ist, denn sonst würde die Übersichtlichkeit erheblich leiden.
Abschließend möchte ich auch nochmal daran erinnern, warum schlußendlich bis zur Übergabe im Schockraum die invasiven Massnahmen ca. 90min und somit zweifelhafter Prognose fortgeführt wurden:
- Relativ junge Patientin
- Beobachteter Kreislaufstillstand ohne relevante no-flow time, sofortiger Beginn eines suffizienten ALS
- Primärer Rhythmus Kammerflimmern
- Bei ROSC sofortige suffiziente Eigenatmung und Notwendigkeit einer Narkoseeinleitung
- Offensichtliche Myokardischämie als Ursache und somit potentiell reversibel
- Zwischenzeitlich mehrere Phasen von ROSC und das Gefühl, dass man positiv Einfluss auf den Zustand nehmen kann
Dennoch ist und bleibt es eine Einzelfallentscheidung des Rettungsteams so lange die Massnahmen fort zu setzen und ich bin froh, dass das Schockraumteam dies auch so respektiert und Verständnis gezeigt hat.
Fallbericht Lungenembolie

Erneut möchte ich von einem Einsatz berichten, an dem ich selbst nicht beteiligt war. Er ist jedoch in meinen Augen sehr lehrreich, und daher möchte ihn auch in seiner Komplexität vorstellen. Nur so viel zu dem gelegentlich geäußerten Vorwurf ich würde mich mit den Fallvorstellungen "abfeiern" oder über andere Kollegen lästern. Dies ist sicher nicht der Fall, sondern der Lerneffekt ist das einzige und entscheidende Element.
Rettungswagen, Notarzt und die Bergwacht werden zu einer Synkope an einen Wasserfall alarmiert. Der 56jährige Patient ist nach einem Fußmarsch von Notarzt und Bergwacht relativ rasch auf zu finden und sein Status ist offensichtlich besorgniserregend:
A: frei
B: Dyspnoe mit einer Raumluftsättigung von 65% bei gutem Pulssignal, offensichtliche Zyanose, beidseits vesikuläres Atemgeräusch. Bei 15l/min Sauerstoff maximal 85% zu erreichen.
C: Sinustachykardie 116/min, RR 100/60mmHg, kaltschweißig, kühle Finger und somit auch verlängerte Rekap-Zeit. Im Verlauf 12-Kanal-EKG mit Rechtstyp, ST-Senkung und T-Negativierung in II, III, und aVF
D: GCS 15, Todesangst
E: Kein Trauma
S: Der Patient berichtet die Atemnot habe sich innerhalb von kurzer Zeit während einer Wanderung entwickelt, kurz davor seien heftige Schmerzen in einem Bein aufgetreten. Er könne nicht mehr weiter gehen und sei auch in sich zusammengesackt.
A: Bestehen nicht
M: Keine
P: Bandscheiben-OP vor 6 Wochen. Heterozygote Faktor V-Mutation, Z.n. tiefer Beinvenenthrombose
L: Vesper bei der Wanderung
E: Kein Trauma, kein Umwelteinfluss
R: Zurückliegende Immobilisation
Aufgrund des kritischen Patientenzustands und der abgelegenen Einsatzstelle wird ein Rettungshubschrauber mit Windenoption angefordert. Der Patient erhält trotz der eingeschränkten Ressourcen hochdosiert Sauerstoff und ein Venenzugang wird gelegt. Bei der Arbeitshypothese einer Lungenembolie wird dem Patienten 10.000 I.E. Heparin i.v. verabreicht, worunter sich die pulsoxymetrische Sättigung schneller erholt als es eigentlich sein könnte. Parallel dazu wird der Patient zur Windenoperation vorbereitet und ein Helfer holt das Lysemedikament aus dem Notarztfahrzeug (was natürlich outdoor etwas Zeit benötigte). So ist die Metalyse auch noch nicht verabreicht, als die beiden Hubschraubernotärztinnen eintreffen (aufgrund eines Line-Checks zu zweit). Die Übergabe erfolgt strukturiert und fokussiert vom bodengebundenen Primär-Notarzt. Die übernehmende Ärztin verschafft sich parallel zur Monitorisierung des Patienten im Luftrettungssack noch einen kurzen Überblick über den anhaltend kritischen Patienten. Dabei erscheint es ihr so, als könne man im schmerzenden Bein keinen Leistenpuls tasten. Sie wirft daraufhin ein, es könne sich ja auch trotz aller Indizien für eine Lungenembolie auch um eine Aortendissektion handeln. Daraufhin einigt man sich auf die Lyse aus Sicherheitsgründen zu verzichten und stattdessen den Patienten innerhalb von 10min nach Aufnahme in den Helikopter in ein Zentrumskrankenhaus zu fliegen und zunächst eine Bildgebung ab zu warten. Ein präklinischen Ultraschallgerät stand bei diesem Einsatz leider nicht zur Verfügung - womit man die Rechtsherzbelastung verifizieren und den Gefäßverschluss des Beins ausschließen hätte können. Ggf. hätte man vielleicht auch Zeichen der Aortendissektion gesehen. Aber nun ja, hätte hätte Fahrradkette...
Wie ging es nun mit dem Patienten in der Klinik weiter?
Bereits in der Notfallechokardiographie im Schockraum zeigte sich eine schwere Rechtsherzbelastung. Im CT konnte die Aortendissektion definitiv ausgeschlossen werden und es zeigte sich eine fulminante Lungenembolie beidseits. Im Verlauf wurde eine tiefe Beinvenenthrombose (TBVT) der Vena femoralis superficialis als Auslöser identifiziert werden. Bei anhaltender klinischer Instabilität entschied man sich sofort nach Aufnahme für ein spezielles Verfahren, dem sog. EKOS. Dabei wird im Herzkatheterlabor ein Katheter in die Lungenkreislauf eingebracht und darüber lokal und selektiv eine Lysetherapie verabreicht, und, dies ist die Besonderheit bei EKOS, unterstützt eine Ultraschallanwendung die lokale Thrombusauflösung durch Destabilisierung der Fibrinmatrix.
Der vorgestellte Patient erholte sich sehr rasch trotz des ausgedehnten Befundes und konnte schon am Folgetag von der Intensivstation verlegt werden. Die heterozygote Faktor-V-Mutation und die körperliche Schonung nach der Wirbelsäulen-OP sorgten mutmaßlich für die unglückliche Verkettung aus TBVT und konsekutiver fulminanter Lungenembolie.
Was kann man daraus lernen?
Durch das moderne Freizeitverhalten kommt es zu wirklich allen Arten von Notfällen in unwegsamen Gelände, so dass eine Zusammenarbeit mit der Bergwacht und Windenoperationen der Luftrettung notwendig werden. Eigentlich lag die Ursache des kritischen Patientenzustands auf der Hand, weil die Anamnese und Klinik klassisch für eine Lungenembolie war. Aufgrund des kritischen Patientenstatus wäre dann eigentlich eine systemische Lyse indiziert gewesen und sie war auch verfügbar. Hätte jedoch die zweite Notärztin mit ihrer Sorge um eine etwaige Aortendissektion bis in die Beingefäße hinein recht behalten wäre der Ausgang durch die Lyse sicher deletär gewesen. Die Abwägung dann zunächst drauf zu verzichten und stattdessen den Fokus auf den raschen Transport zu legen halte ich für gerechtfertigt.
Dennoch vermute ich, dass die Entscheidung bei Einsatz der Notfallsonographie mit Nachweis der Rechtsherzbelastung und Ausschluss eines Gefäßverschlusses des Beins ausgefallen wäre.
Auch in der Klinik ist die Behandlung einer fulminanten Lungenembolie eine diagnostische wie therapeutische Herausforderung bis hin zum Einsatz spezieller Therapieverfahren. Gerade wenn schon die Luftrettung eingesetzt wird ist eine Zielklinik an zu streben, die diesen hohen Ansprüchen gerecht wird. Dadurch lassen sich dann eigentlich unnötige Sekundärtransporte von instabilen Patienten zumeist vermeiden.
Noch etwas für die Nerds: Manchmal findet man 5000 I.E. Heparin und manchmal auch 10000 I.E. als venöse Erstgabe in den Büchern. Aber was nun? Eindeutig ist es nicht: Formell werden 80 I.E./kgKG empfohlen, an anderer Stelle wird eine PTT-gesteuerte Gabe (60-80sec) empfohlen, was wir aber präklinisch ja nicht messen können. Somit müßten einerseits rechnerisch die 5000 I.E. grob oft ausreichend sein, andererseits ist meine persönliche Erfahrung, dass man bei einem normalgewichtigen Erwachsenen und 10.000 I.E. Heparin meist keine PTT von 60-80 sec erreicht, so dass in der Klinik mit einem Heparinperfusor weitergemacht wird. Bevor man sich aber an diesen Zahlenspiele ergötzt sollte man sich auch nochmal klar machen, dass ich mit der Antikoagulation nur ein weiteres Thrombuswachstum unterbinden will, auflösen tu ich ihn egal mit welcher Dosis mittels Heparin nie. Die Thrombuszerlegung erfolgt entweder innerhalb der nächsten Tage durch die körpereigene Fibrinolyse oder schneller durch die externe Lysetherapie. Mit dem Heparin versuche ich also nur Zeit zu gewinnen und eine Verschlimmerung der Thrombuslast zu verhindern. Eine zusätzliche Gabe von ASS zur Thrombozytenaggregationshemmung wird übrigens nicht empfohlen.
Fallbericht Hyperkaliämie

Heute möchte ich über einen Patienten mit Hyperkaliämie vorstellen und dabei die wichtigsten Facts dazu für mich vorstellen:
Es handelt sich um einen 89jährigen Patienten, der eine bekannte chronische Niereninsuffizienz hat und schon mehrfach wurde es in der Vorgeschichte notwendig den Kaliumspiegel zu senken. Bisher musste er jedoch noch nie stationär deswegen aufgenommen werden.
Weitere relevante Vorerkrankungen:
- Mittelschwere Aortenklappenstenose und Trikuspidalinsuffizienz, jedoch mit erhaltener linksventrikulärer Funktion
- Vorhofflimmern unter Apixaban
- Arterielle Hypertonie
- NIDDM
Es wird schließlich der Hausarzt angerufen und um einen dringenden Hausbesuch gebeten, da der Patient mehrfach kurz in sich zusammengesunken und dabei "seltsam gezuckt" hätte. Glücklicherweise sei er bisher dann immer wieder zügig erwacht, ist aber anhaltend blass und schweißig. Der Blutzucker wurde bestimmt und als Ursache ausgeschlossen.
Der Haus- und gleichzeitig Notarzt (nicht ich ;-)) stellt bei seinem Eintreffen folgenden Status fest:
A: frei
B: Leichte Rasselgeräusche beidseits, SpO2 bei Raumluft 89%
C: Kammerersatzrhythmus mit etwa 30/min, RR 70/40mmHg
D: Dem Patienten ist übel und er ist müde, zwischenzeitlich verliert er mehrfach kurz das Bewusstsein und zeigt dabei kurze klonische Entäußerungen
E: Es wird über einen übelriechenden Urin berichtet
Es wird bei dieser kritischen Situation umgehend ein RTW und ein RTH zum Transport in ein weiter entferntes Zentrum angefordert.
Als Erstmassnahme wird der Patient hingelegt, Sauerstoff über eine Maske verabreicht und ein Venenzugang gelegt.
Auf Atropin bis hin zu einer Gesamtdosis von 2mg reagiert der Patient nicht.
Daraufhin werden Defibrillationselektroden in der a.p.-Position aufgebracht und ein Schrittmacherversuch unternommen, was aber auch nur intermittierend und auch nur mit eingeschränktem Erfolg funktioniert.
Auch eine andere Elektrodenposition bringt keinen Benefit.
Schlußendlich wird der Patient luftgebunden in eine Herzklinik transportiert, wo er direkt bei Aufnahme ein transvenöses Pacing erhält. In der Blutprobe wird ein Kalium von 7mmol/l festgestellt, woraufhin ein Shaldon angelegt und unmittelbar mit einer Notfalldialyse begonnen wird. Nach Normalisierung des Kaliumspiegels stabilisiert sich die Herzfrequenz zunächst, bei einer erneuten bradykarden Phase wird schließlich ein endgültiger Schrittmacher implantiert.
Die Hyperkaliämie wurde am ehesten durch einen Harnwegsinfekt mit konsekutivem antut-auf-chronischem Nierenversagen ausgelöst. Nach antibiotischer Behandlung verbessern sich die Retentionsparameter sowie die Kaliurese, so dass die Akutdialyse wieder eingestellt werden kann.
Soweit zum Fall - nun noch etwas zur dahinter stehenden Theorie:
Kalium
Kalium ist das wichtigste Kation (positiv geladenes Teilchen) innerhalb unserer Zellen. Daher verbergen sich auch 98% des Körperkaliums in der Zelle. Also messen wir mit unserer Blutkaliumkonzentration nur die schlappen 2% extrazelluläres Kalium - ähnlich ist es aber häufiger, beispielsweise beim Blutzucker - auch hier interessiert unserer Körper eigentlich viel mehr die intrazelluläre Konzentration. Da man aber nunmal Blut besser untersuchen kann als Zellen und man so auch die nötigen Informationen erhält passt es auch so. Gut 70% des Körperkaliums versteckt sich übrigens in den Muskelzellen, daher ist es klar, dass man bsp. bei einem Liege- oder Chrush-Trauma auch eine Hyperkaliämie fürchten muss. Passend dazu sei die sog. Pseudohyperkaliämie durch Hämolyse bei der Blutentnahme genannt. Diese passiert recht häufig, v.a. wenn sich die Blutentnahme schwierig gestaltet. Dabei platzen die Erythrozyten und ihr Kalium wird frei, was bereits den Messwert empfindlich verändern kann. Es ist jedoch eine absolute Laborente und hat keine Konsequenz. Wer die Pseudohyperkaliämie fälschlicherweise behandelt gefährdet natürlich seinen Patienten, daher sollte man den Wert immer in Zusammenhang mit dem klinischen Erscheinungsbild des Patienten in Zusammenhang stellen.
Es steht und fällt alles mit der Verteilung zwischen dem Intra- und Extrazellularraum, da dies zum Ladungsunterschied zwischen "innen" und "außen" und somit die Zellfunktion hat. Diesen Ladungsunterschied bewerkstelligt das sog "Shifting" über die Zellwand. Wen interessiert das? Wartet ab....
Für die Entstehung einer Hyperkaliämie (über 5 bzw. 5,5mmol/l) gibt es mehre eigentlich logische Ursachen:
- Erhöhte Kaliumzufuhr: Unser Magen-Darm-Trakt bekommt es normalerweise schon hin nur bis zu einem gewissen Grad Kalium auf zu nehmen, den Rest scheiden wir hinten einfach wieder auf. Nur wenn uns der Geschmack von Kalium-Brausetabletten so reizt oder wir löffelweise Salz auf Kaliumbasis essen könnte es ein Problem werden. Die "normalen" kaliumhalsten Nahrungsmittel wie Obst, Gemüse, Nüsse und Fleisch machen eigentlich kein Problem und sollten nur bei bekannter Hyperkaliämie reduziert werden. Ansonsten kann man auch die Magen-/Darmschleimhaut dazu bringen weniger Kalium auf zu nehmen, dazu unten mehr.
- Verminderte Kaliumexkretion: Hier ist die Niere zu 80-90% zuständig. Kurz: Keine Nierenfunktion, kaum Kaliumausscheidung. Im anurischen Nierenversagen und bei normaler Kaliumzufuhr steigt das Kalium etwa um 1 mmol/l am Tag an. Manchmal sind wir auch selber schuld, denn es gibt mehrere Medikamente (als populärsten Vertreter seien hier exemplarisch die ACE-Hemmer zu nennen) welche die Kaliumausscheidung durch die Nieren verringert. Also gilt besondere Vorsicht bei niereninsuffizienten Patienten welche (wie fast immer) eine differenzierte Dauermedikation haben.
- Kaliumaustausch an der Zellmembran: Hierfür bedarf es einiger Grundvorraussetzungen, dass hier durch geschicktes Verschieben von Kationen und Anionen über die Membran das sog. Membranpotential aufgebaut werden kann. Besonders wichtig ist hier auch wieder das Kalium. Der Kaliumtransport über die Membran ist abhängig von vielen Dingen wie pH, Blutzucker, Insulin, Serumosmolarität sowie die Funktion der Ionenkanäle an sich.
EKG-Zeichen
Es gibt mehrere Veränderungen im EKG, die bei einer Hyperkaliämie vorkommen können, beweisen tun sie es aber nie, da es für jede Veränderung auch andere Gründe gibt. So gibt es mitunter ein hohes sowie spitzes T (könnte bei einer ganz frischen Myokardischämie ähnlich aussehen - sog. Erstickungs-T). Es kann zu SA- oder AV-Blöcken kommen (könnte aber auch an einer Ischämie liegen, insbesondere im Bereich des Vorhofs bzw. AV-Knoten. Der QRS-Komplex kann verbreitert sein, QT jedoch verkürzt und das P an sich abgeflacht. An schlimmen Herzryhtmusstörungen drohen neben dem höhergradigen AV-Block auch eine Asystolie oder auch Kammerflimmern. Man merkt, es kann bei Hyperkaliämie fast zu allem elektrophysiologischen Unheil kommen. Schlußendlich ist dies alles begründet in der Verlangsamung und Abflachung der Aktionspotentials. Dies war übrigens im vorgestellten Fall vermutlich die Ursache, dass der externe Schrittmacher trotz Umpositionierung und hoher Energien nicht zuverlässig funktionieren wollte.
Behandlungsoptionen
Reduktion der Kaliumzufuhr
- Ist logisch, im Zweifelsfall muss man auf Früchte, Nüsse etc (s.o.) halt mal verzichten. Sollte künstlich enteral oder parenteral Kalium zugeführt werden, ist dies umgehend zu stoppen
- Mit Kationenaustauscherharzen wie Resonium kann man im Darm den Austausch von Natrium und Kalium beeinflussen, was aber seine Zeit braucht und in der Effektivität schlußendlich auch endlich ist. Ob es somit die Kaliumzufuhr oder -ausscheidung beeinflusst kann man diskutieren, ist aber auch egal.
Förderung der Kaliumaufnahme in die Zelle (Shifting)
- Eine Insulin-Glukose-Infusion ist zumindest am Anfang zumeist ein effektives Mittel, nützt aber im Rettungsdienst nichts, da wir weder den Kaliumwert bestimmen können noch Insulin dabei haben. Wirkdauer ca 4-6h.
- Das gute alte Natriumbicarbonat kann auch seine Verwendung finden, aber eigentlich nur wenn man von einer begleitenden Azidose weiß (was aber eigentlich immer der Fall ist). Die blinde Gabe eines Puffers ist aber natürlich nicht ungefährlich, in verzweifelten Situationen kann es aber die letzte Rettung sein als Ultima Ratio und Einzelfallentscheidung des Arztes. Im vorgestellten Fall war übrigens kein NaBic verfügbar, weil es nicht mehr vorgehalten wird.
- Eine Inhalation von Beta-2-Sympathomimetika wie Salbutamol kann zu Beginn auch mal etwas Zeit einbringen, weil es auch den Kalium-Shift positiv beeinflusst und die drohenden Nebenwirkungen vergleichsweise gering sind.
Förderung der Kaliumausscheidung
- Gabe von kaliumarmen Infusionslösungen (welche genau ist häufig Streitpunkt der Gelehrten) führt zu einer Verdünnung im Blutkreislauf uns zu einer Erhöhung der Primärfiltrats der Nieren. Schütte ich aber viel Volumen in einen Patienten mit aufgehobener oder eingeschränkter Diurese in den Patienten kann mir dieser quasi in der Hypervolämie und nachfolgendem Herzversagen "ertrinken", also ist hier auch Vorsicht angebracht. Parallel sollte man eh die Diurese durch Schleifendiuretika (senken eh schon immer eher den Kaliumspiegel) erhöhen um das Kalium besser aus zu waschen. Und ja, es ist bei einer klinisch relevanten Hyperkaliämie in der Präklinik wirklich mal wert, dass die Trage nass wird oder die Urinflasche herausgekramt werden muss, weil es eben nicht so viele andere wirksame Optionen gibt. Nur die wenigsten werden präklinisch einen Blasenkatheter zur Bilanzierung und zur Leidensverminderung des Patienten dabei haben.
- Die Dialyse ist natürlich hoch effektiv und die Möglichkeit dazu ist ggf. schon bei der Klinikanmeldung zu erfragen.
Membranstabilisierung
Hierbei wird am Kaliumwert rein nichts verändert, sondern das Risiko maligner Herzrhythmusstörungen sinkt durch eine Verbesserung des Membranpotentials. Erreicht werden kann dies einfach aber nur kurzfristig durch die Gabe von beispielsweise 10ml Calciumglukonat 10%. Auch dieses Hilfsmittel war im vorgestellten Fall leider nicht zur Verfügung gestanden.
Kurzum: Ein nicht alltäglicher Fall, der heutzutage bei vielen Menschen mit Niereninsuffizienz aber schon mal auch in dieser Ausprägung vorkommt und unsere Hirnwindungen beansprucht. Da die präklinischen Therapieoptionen häufig sehr eingeschränkt sind ist schnelles Handeln gefragt und zeitgleich aber auch eine geschickte Wahl der Zielklinik. Die kleine Klinik "ums Eck" ohne Möglichkeit einer Dialyse auf der Intensivstation ist trotz minimaler Prähospitalzeit vermutlich nicht geschickt. Auch hier hilft wie so oft, wenn man die umliegenden Kliniken in der Region gut kennt, denn dies erspart dann einige Telefonate und wenn es dumm läuft auch einen Sekundärtransport.
Notfallmedizinische Automatismen: Nicht immer ein Segen
Wir predigen in der notfallmedizinischen Aus- und Fortbildung leitlinien- und v.a. algorithmenbasiertes Arbeiten. Das ist auch gut und richtig so, weil es unser Arbeiten evidenzbasiert, aktuell und v.a. schnell macht. Man bedient sich hierbei auch dem sog. "Pattern Recognition", also einer Mustererkennung. Wir erkennen in einem Patienten bzw. seinen Symptomen ein bestimmtes Muster, welches in uns quasi den scheinbar bestmöglich passenden Algorithmus "auslöst". So müssen wir nicht jede Patientenversorgung von vorne durchdenken und planen, oder anders gesagt bei jedem Einsatz das Rad neu erfinden. Auf diese Art können wir unser Hirnschmalz schonen und handeln fast immer richtig. Hier unterscheidet sich auch der Routinier vom Novize, weil der die Muster schneller erkennt. Langjährige Erfahrung kann einem hier jedoch auch ein Schnippchen schlagen, weil die Gefahr von Fixierungsfehlern mitunter ansteigt. Während der Novize noch die Differentialdiagnosen durchgeht hat der "Altmeister" schon längst den Patienten in eine Musterschublade gesteckt.
So könnte es auch zu folgendem Fall gekommen sein:
Eine 72jährige Dame sucht ihren Hausarzt auf, weil sie seit ein paar Wochen gelegentlich einen retrosternalen Druck verspürt, welcher jedoch ohne weitere Massnahmen wieder vergeht. Da die Patientin die Situation nicht als dringlich ansieht, wartet sie geduldig auf einen Elektivtermin beim Hausarzt. Am Tage der Vorstellung ist sie komplett beschwerdefrei. In der hausärztlichen Praxis wird dann ein vermeintlich neuaufgetretener Linksschenkelblock (LSB) festgestellt. Seit Jahren weisen die einschlägigen Leitlinien darauf hin, dass bei PASSENDER SYMPTOMATIK ein LSB als STEMI-Äquivalent zu werten ist. Diese Aufwertung erfolgte auch dann, da man postulierte, dass bei einem Blockbild im EKG die ST-Strecke als Ischämiemarker nicht beurteilt werden könne. Dies ist auch zugegebenermassen nicht trivial, aber nicht unmöglich. So wurden zunächst die Sgarbossa-Kriterien entwickelt und später durch die Barcelona-Kriterien aktualisiert, welche auch eine ST-Analyse trotz LSB zulassen. Einen klasse Blogbeitrag hierzu von meinem geschätzten Kollegen Sebastian Casu findet ihr hier:
http://sebastian-casu.com/blog-57-stemi-bei-linksschenkelblock-die-barcelona-kriterien/
Aber nun zurück zum Fall: Der EKG-Ausdruck führte ohne weitere Nachfragen oder Abklärungen sofort zur Notarztalarmierung mit dem Stichwort "STEMI". Die Patientin wußte gar nicht, wie ihr geschah, denn schließlich fühlte sie sich heute blendend und gut belastbar. Aufgrund der ländlichen Lage entschloss sich die Rettungsleitstelle auch gleich zu einer Parallelalarmierung eines RTH, da das lokale Herzkatheterlabor nur zu den Bürozeiten besetzt ist. Der bodengebundene Notarzt meldete parallel zur Standardversorgung (300mg ASS, 5000IE Heparin, 2mg Morphin) schließlich die Patientin unter Umgehung näher liegender kleinerer Krankenhäuser in einem ca 60km entfernten Maximalversorgerhaus an und verbrachte die Dame dann zum Hubschrauberlandeplatz. Dort angekommen klagte sie über Palpitationen, Angst und leichte Übelkeit. Die Herzfrequenz lag bei 115/min und der RR bei 200/110mmHg. Auch darunter kam es jedoch weder zu Luftnot noch zu pectanginösen Beschwerden. Sie war erschüttert über die Diagnose eines Herzinfarktes und machte sich große Sorgen um ihre Familie.
Zur Anxiolyse und Stressreduktion wurden neben 4mg Ondansetron auch die restlichen 8mg Morphin sowie 5mg Metoprolol verabreicht, woraufhin sich alle Beschwerden unmittelbar legten. Nach telefonischer Rücksprache mit dem aufnehmenden Zentrum erfolgte dort ein Downgrade der Patientin hin zu einem "NSTEMI-ACS" und somit Vorstellung über die Notaufnahme und nicht gleich im Herzkatheterlabor. Schlußendlich genoß die Patientin sichtlich den Flug, auch wenn sie weiterhin die Krankenhausaufnahme an sich für übertrieben hielt. Bei der Übergabe war die Herzfrequenz bei 75/min und der RR 135/83. Dies verschlechterte sich auch nicht, obwohl der aufnehmende Klinikarzt die Übergabe mit einem Kopfschütteln quittierte.
Was ist nun die Lehre aus der Geschichte: Klar gibt es atypische Präsentationen eines ACS, neben Diabetikern sind insbesondere Frauen hiervon betroffen. Bei den ACS-Kriterien werden jedoch schon Symptome irgendeiner Art gefordert, beim STEMI noch mehr. Hier lag aber durch den scheinbar neu aufgetretenen LSB ein Fixierungsfehler vor, welcher zu einer ganzen Versorgungskaskade führte.
Trotzdem mag ich aber nicht mit nacktem Finger auf angezogene Leute (Kollegen) zeigen: Auch mir sind schon so viele Fixierungsfehler unerlaufen, nur dieser Fall hier ist so ein schönes Beispiel, dass ich es hier aufgegriffen habe.
Man darf jedoch festhalten, dass es die Patientin nicht gefährdet sondern vielmehr zu einer qualitativ extrem hochwertigen und definitiven Abklärung geführt hat. Die hohen Kosten und der Ressourceneinsatz blenden wir aber mal wohlwollend aus...
Es wäre auch nicht verwunderlich, wenn sich diese Fälle häufen aus einem hohen Sicherheitsbedürfnis der ärztlichen und nichtärztlichen Kollegen heraus: Viele scheuen die Diskussionen, Argumente und vermeintlich drohende Konsequenzen einer Risiko- und Ressourcenabwägung. Aus einem Sicherheitsbedürfnis heraus die Maximalvariante der Versorgung zu wählen lässt sich immer irgendwie rechtfertigen bzw. durchsetzen. Andererseits strapaziert dies natürlich die Versorgungsressourcen. Ich versuche es mir daher nicht leicht zu machen, sondern rational, analytisch sowie weitsichtig die Situation zu erfassen, um Fixierungsfehler zu minimieren (ausschließen können es Menschen nie). Dies ist dann mit den Bedürfnissen und Wünschen des Patienten ab zu gleichen bzw. in Einklang zu bringen. Dies kostet jedoch Zeit und gute Argumente bzw. ein ehrlich-empathisches Gespräch. Lauter Dinge, mit denen wir in der Notfallmedizin häufig nicht gesegnet sind, dennoch liebe ich dieses Spannungsfeld!
Fallbericht Tachymyopathie

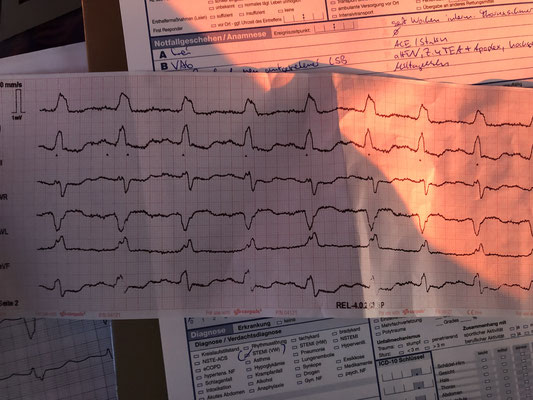
Heute möchte ich kurz von einem interessanten Einsatz dieser Tage berichten. Eine RTW-Besatzung fordert mich nach zu einem Patienten mit Brustschmerzen. Ein Hausarzt hatte den RTW zum Transport in eine Klinik angefordert, er hat dem Patienten bereits ein EKG geschrieben (siehe erstes Bild, ob er mit den Kringeln einen Hinterwand-STEMI markieren will weiß ich nicht und würde auch nicht zustimmen bzw. fände es noch befremdlicher keinen NA zum Patienten mit Brustschmerzen hinzu zu rufen) sowie warum auch immer 2 Hub Nitro gegeben. Der Trop-Schnelltest sei negativ gewesen, allerdings weist der Patient keine Einstichstelle wo auch immer auf... Auf der Einweisung steht Schmalkomplextachykardie. Von Anfang an war die Herzfrequenz bei ca. 160/min. Ich weiß, es klingt alles etwas verwirrend, aber so war mein Informationsfluss.
Der Patient berichtet mir von heftigen Brustschmerzen, welche bereits seit dem Morgen bestehen und seither zunehmen würden. Er habe dann gegen 19 Uhr spontan seinen Hausarzt aufgesucht, der gemeint hätte er müsse zum Ausschluss eines Herzinfarkts in die Klinik. Er habe so etwas noch nie gehabt und sei sonst gesund, gehe aber auch nicht gern zum Arzt.
Ich schaue mir das EKG nochmal an und es gehen mir folgende Gedanken durch den Kopf: Auffällig ist die regelmäßige Schmalkomplextachykardie um 160/min. Eine P-Welle kann ich nicht ausmachen und es gibt für mich auch keinen wirklichen Grund für eine Sinustachykardie: Der Patient hat weder Schmerzen noch erscheint er aufgeregt. Für die Erstmanifestation einer Reentry-Tachykardie ist er mir zu alt (ca 60 Jahre) und die Frequenz wäre hierfür recht langsam. Für ein tachykardes Vorhofflimmern sind die Komplexe zu regelmäßig. Der QRS ist schmal, so dass auch eine (slow) VT für mich ausscheidet.
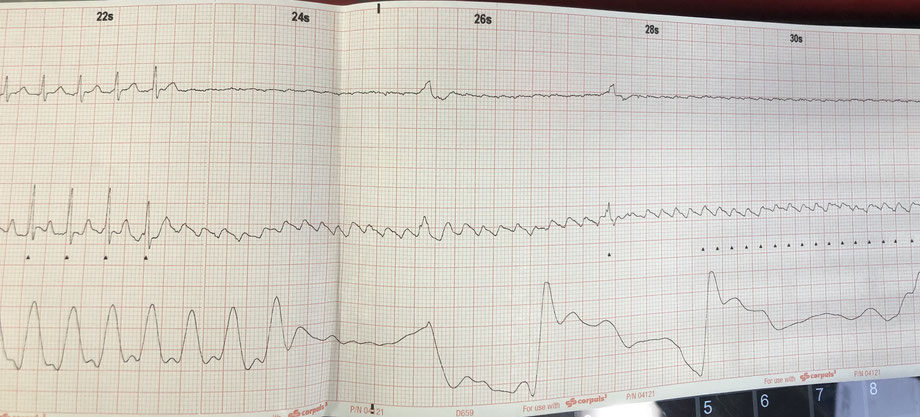
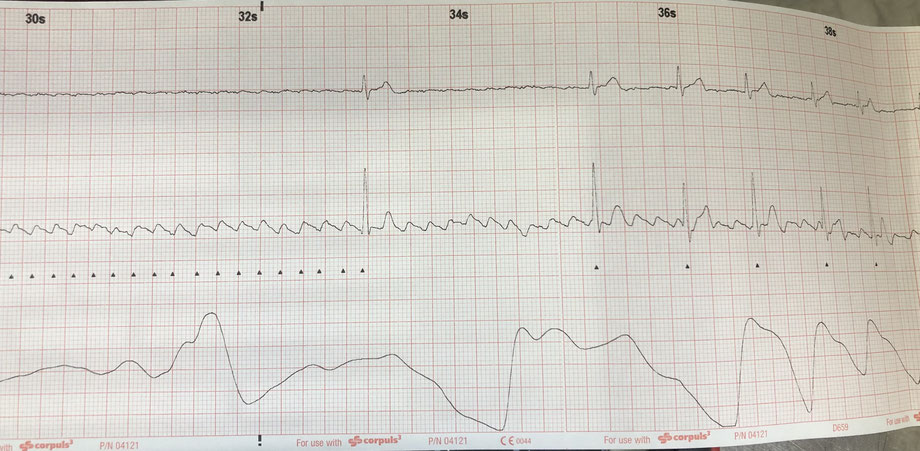
Da ein Valsalva-Manöver misslingt entscheide ich mich zur Gabe von Adrekar (Adenosin) unter Reanimationsbereitschaft. Auf die rasche Injektion und Einspülen von 6mg Adrekar kommt es nur zu einer sehr kurzen Bradykardie, so dass keine weitere Diagnose gestellt werden kann. Auf 12mg Adrekar hin ist die ventrikuläre Pause deutlich länger, ehe es erneut zur vorherigen Tachykardie kommt. Aber zwischendrin erkennt man schön die Ursache: Während man in Ableitung I noch recht wenig sieht bzw. von einem Vorhofflimmern ausgehen könnte, sieht man in Ableitung II ein astreines Vorhofflattern (siehe hierzu auch den älteren Beitrag zu den sog. Lewis-Leads). Es kann sich somit eigentlich nur um ein Vorhofflattern mit einer regelmäßigen 2:1-Überleitung handeln.
Zur Soforttherapie werden 5mg Metoprolol und weniger evidenzbasiert 2g Magnesium in 500ml kristalliner Flüssigkeit verabreicht, woraufhin die Herzfrequenz zwischenzeitlich auf ca 100/min sinkt und sich dann keine Ischämiezeichen im EKG zeigen. Zu diesem Zeitpunkt ist der Patient dann auch beinahe beschwerdefrei.
Da aber ein NSTEMI-ACS natürlich nicht ausgeschlossen werden kann, erfolgt ergänzend die Gabe von 250mg ASS, 5000 IE Heparin und prophylaktisch 4mg Ondansetron. Es erfolgt anschließend der Transport in die Klinik zur weiteren Abklärung.
Ich habe den Fall nicht weiter verfolgt, aber ich vermute mal, dass es sich nicht um eine primäre Coronarokklusion oder hochgradige Stenose gehandelt hat. Vielmehr waren die Brustschmerzen Ausdruck einer sogenannten Tachymyopathie. Durch die Tachykardie braucht der Herzmuskel viel mehr Sauerstoff als bei einer normalen Herzfrequenz. Zudem erfolgt die Perfusion der Coronarien während der Diastole, die mit steigender Herzfrequenz immer kürzer wird. Zusätzlich kontrahieren sich die Vorhöfe einerseits durch das Flattern eh viel zu schnell (250-350/min) was ineffektiv ist, zum anderen kann auch die ventrikuläre Füllung durch die stundenlange Tachykardie leiden, denn dies ist ja mehr ein passiver Vorgang welcher Zeit braucht. Somit reduziert sich das Herzzeitvolumen uns sekundär der Blutdruck merklich. Die niedrigere diastolische Blutdruck sorgt dann für eine weitere Reduktion der Coronarperfusion - ein unheilvoller Circulus vitiosus beginnt. In der Klinik bleiben solche Fälle spannend, weil es zumeist durch den myokardialen Stress auch zu einer Erhöhung der Herzenzyme kommt. Manche sprechen dann auch von einem Typ 2 - Myokardinfarkt, da keine Coronarokklusion vorliegt sondern es sich lediglich um eine relative Minderdurchblutung und Sauerstoffschuld handelt. Solche Patienten profitieren dann oftmals nicht von einer notfallmäßigen Herzkatheterintervention. Vielmehr gilt es die Ursache der verminderten Coronarperfusion zu erkennen und behandeln, in diesem Fall die Tachykardie. Hier sollte man auch klären, warum es plötzlich und scheinbar erstmalig zum Vorhofflattern gekommen ist. Ansonsten ist eine langfristige Frequenzkontrolle und Antikoagulation oder noch besser die Rhythmuskonversion in einen Sinusrhythmus (medikamentös oder elektrisch) an zu streben.
Ok, Ok, der letzte Abschnitt hatte einen gewissen Nerd-Faktor, ich gebe es ja zu, aber ganz so einfach ist Notfallmedizin eben auch nicht. Noch viel mehr als die Pathologie dahinter zu beherrschen ist mir jedoch sie überhaupt zu erkennen, was scheinbar nicht jedermann gelingt. So will ich auch hier nicht lästern oder mahnend den Finger heben, sondern demütig zum lebenslangen Lernen aufrufen. Die Chancen liegen arbeitstäglich quasi vor unseren Füßen, wir müssen sie nur erkennen und ergreifen.
Zudem hoffe ich auf Gnade der echten Kardiologen. Ich weiß, die Zusammenhänge und Details sind noch komplexer als von mir vereinfacht dargestellt, aber ich wollte den Nerd-Faktor nicht noch mehr in die Höhe treiben. Keine Frage, solche Patienten gehören zeitnah in Eure Behandlung!